Video - musstewissen Chemie" zu Bohrsche Schalenmodell
- Jeder Stoff besteht aus kleinsten, unteilbaren Teilchen, den Atomen.
- Alle Atome eines Elements haben das gleiche Volumen und die gleiche Masse.
Die Atome unterschiedlicher Elemente unterscheiden sich in ihrem Volumen und in ihrer Masse.
© Wikipedia, Demokrit, 28.01.2020, Angepasst von A.Spielhoff, CC BY SA 3.0
- Atome sind unzerstörbar. Sie können durch chemische Reaktionen weder vernichtet noch erzeugt werden.
- Bei chemischen Reaktionen werden die Atome der Ausgangsstoffe nur neu angeordnet und in bestimmten Anzahlverhältnissen miteinander verbunden.
© Wikipedia, John Dalton, 27.01.2020, CC BY SA 3.0
Möglichkeiten von Atomen:
- Atome können Elektronen abgeben und werden dann zu elektrisch positiv geladenen Ionen (Kationen).
- Atome können Elektronen aufnehmen und werden dann zu elektrisch negativ geladenen Ionen (Anionen).
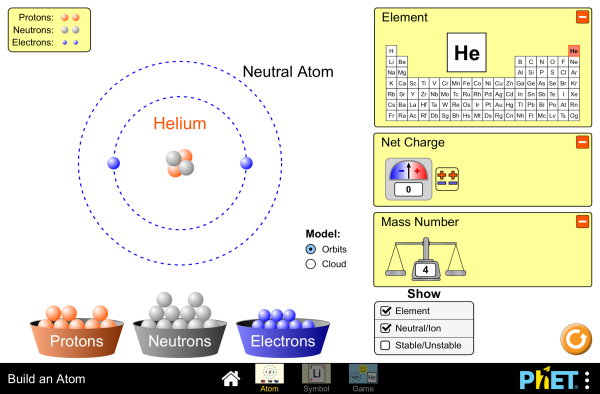
- Das Atom besteht aus einem Atomkern und einer Atomhülle.
- Der Atomkern ist aus positiven Protonen aufgebaut, ist damit elektrisch positiv geladen und befindet sich im Zentrum des Atoms.
- Der Durchmesser des Atomkerns beträgt nur ein Zehntausendstel des gesamten Atomdurchmessers.
- In der Atomhülle befinden sich negativ geladene Elektronen, die um den Atomkern kreisen.
- Die Atomhülle ist ein fast „leerer“ Raum, da die Elektronen noch viel kleiner sind als der Atomkern.
- Atome enthalten eine gleiche Anzahl von positiv geladenen Protonen und negativ geladenen Elektronen, daher sind Atome nach außen hin elektrisch neutral.
- Die Atomhülle mit Elektronen besteht aus mehreren Schalen.
Jede Schale fasst eine bestimmte maximale Anzahl von Elektronen:- K-Schale=2
- L- Schale=8
- M-Schale=18
- etc. (maximale Elektronen = 2⋅Schalen 2)
A.Spielhoff, Atom im Schalenmodell beschriftet Schalen , CC BY 4.0
Das Schalenmodell
Das Schalenmodell (oder auch Atommodell nach Bohr) begründet auf der Annahme, dass die Elektronen den Atomkern in bestimmten Abständen umkreisen. Diese Aufenthaltsräume werden Schalen genannt. Sie werden ausgehend vom Atomkern K-, L-, M-, N- Schale usw. bezeichnet.
Elektronen befinden sich im Atom in ganz bestimmten Abständen vom Atomkern auf Schalen. Zwischen diesen Schalen liegt ein leerer Raum. Elektronen können und dürfen sich nur auf den Schalen und nicht in den “verbotenen Zonen” aufhalten.
Besetzung der Schalen
- Bei der Besetzung der Elektronenbahnen gilt:
Die Anzahl der Elektronen in ungeladenen Atomen ist genau so groß wie die Anzahl der Protonen. (Ionen bilden hier eine Ausnahme)
Beispiel links: Das Argon Atom hat 18 Protonen und 18 Elektronen.
Die Ordnungszahl eine Atomen gibt die die Anzahl der Elektronen an. - Prinzip der geringsten Energie:
Die Schalen werde immer von innen nach außen gefüllt.
Beispiel links: Kohlenstoff hat 2 Elektronen auf der K-Schale (die zuerst besetzt wurde) und 4 auf der L-Schale. Im Kern hat das Kohlenstoff Atom 6 Protonen und 6 Neutronen und ist damit Elektrisch neutral. - Oktettregel:
Auf der äußersten Schale befinden sich nie mehr als 8 Elektronen. - Berechnung der maximalen Elektronen pro Schale:
Für die K-. L- und M-Schale gilt: Die maximale Anzahl der Elektronen pro Schale ergeben sich aus der Formel 2n2 (n= Schalenzahl).
Daraus ergibt sich folgendes Prinzip:
K-Schale (n= 1): Maximale Elektronenzahl 2
L- Schale (n= 2): Maximale Elektronenzahl 8
M- Schale (n= 3): Maximale Elektronenzahl 18
N-Schale (n= 4): Maximale Elektronenzahl 32Vereinfacht könnt ihr euch Merken:
1 Schale = 2 Elektronen
alle anderen Schalen = 8 Elektronen (Oktettregel)
Text von serlo.org,Schalenmodell, Angepasst von A.Spielhoff, CC BY-SA-4.0
A.Spielhoff, Argon Atom im Schalenmodell beschriftet mit Atomkern , CC BY 4.0
A.Spielhoff, Kohlenstoff Atom im Schalenmodell , CC BY 4.0
Schalenmodell und das Periodensystem
- Ordnungszahl = Anzahl der Protonen
- Ordnungszahl = Anzahl der Elektronen
- römische Hauptgruppennummer = Anzahl der Valenzelektroen (Aussenelektronen)
- Massenzahl = Gewicht der Atome in Unit (ergibt sich aus der Protonen,- und Neutronenanzahl)
- Neutronenzahl = Massenzahl – Ordnungszahl
- Periodenzahl = Anzahl der Schalen
Quantensprünge
A.Spielhoff, Wasserstoff im Schalenmodell mit Emission, CC BY 4.0
In neutralen Atomen ist die Anzahl der Elektronen genau so groß wie die Anzahl der Protonen.
Wenn das Atom aber Elektronen aufnimmt oder abgibt wird es zu einem geladenen Ion (siehe auch Rosinenkuchenmodell).
A.Spielhoff, chemische Reaktion Li + Schalenmodell, CC BY 4.0
Wenn das neutrale Lithium Atom ein Elektronen ab gibt, wird es ein einfach positiv geladenes Lithium Ion (H+) (Kation). Denn der Kern besitzt weiterhin drei positive Protonen aber in der Hülle sind nur noch zwei Elektronen auf der ersten Schale vorhanden.
Das Lithium ähnelt nun äußerlich dem Edelgas Helium, was eine sehr bestrebenswerter Zustand ist.
A.Spielhoff, chemische Reaktion O2- Schalenmodell, CC BY 4.0
Das neutrale Sauerstoff Atom besitzt im Kern 8 Protonen und in der Elektronenhülle 8 Elektronen. Wenn Sauerstoff zwei Elektronen hinzubekommt dann hat es anschließend 10 negative Elektronen in den ersten beiden Schalen aber weiterhin den gleichen positiven Kern.
Das Sauerstoff wird hierdurch zum zweifach negativ geladenen Sauerstoff Ion (O 2–) (Anion).
Die negative Ladung kann man bei dem Modell durch den schwarzen Stecker in der “Steckverbindung” erkennen.
Der Sauerstoff ähnelt nun äußerlich dem Edelgas Neon, was eine sehr bestrebenswerter Zustand ist.
Wichtig: Alle Atome haben das bestreben in ihrer Elektronenhülle einem Edelgas zu ähneln (Edelgaskonfigurationen). In ihrer Edelgaskonfigurationen sind Atome und Ionen energetisch besonders stabil.
Das Schalenmodell lässt sich gut auf Wasserstoffatome anwenden, stößt bei schwereren Atomen allerdings auf seine Grenzen. Obwohl die Elektronen in der Realität nicht auf definierten Bahnen um den Atomkern kreisen, wird das Schalenmodell dennoch oft für Erklärungen herangezogen.
In den 1920er Jahren wurde das Schalenmodell von der Orbitaltheorie abgelöst.
Text von serlo.org,Schalenmodell, Angepasst von A.Spielhoff, CC BY-SA-4.0